Propiedades Periódicas
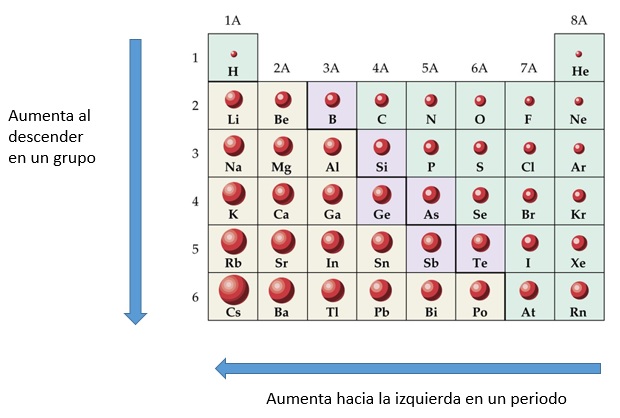
1. Radio atómico en la tabla periódica
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj6HvwBBzNYRkQRBVM_E3-BiunPa4tsD7_EmFofI2m26kcI46dvNuXk12iP8fs7cqDW1RRvPdtL4owuzj2jkTzkYeHDDM-CfYkF1ptCX74qqgPktTlE3gQWG8nXn3cEtb0hM_YcRvs1d-43/s640/tendencia del-radio-atomico.png
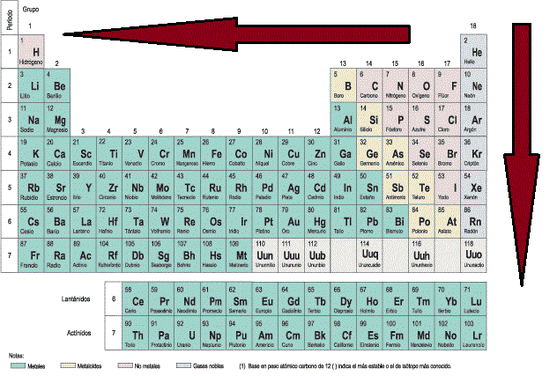
Instrucciones. Utiliza tu tabla de la figura 1 para contestar las preguntas
1. ( ) De acuerdo a la tabla periódica y en relación a los tamaños atómicos A)¿Qué sucede con el radio atómico a medida que se desplaza hacia abajo del grupo?
R= Incrementa su radio atómico desplazándose entre más abajo aumentando su pm
B) ¿Qué sucede cuando se desplaza de izquierda a derecha en los periodos?
R= Disminuye su radio atómico
2. Señale cuál de estos dos elementos tiene mayor radio atómico.
a) Sr y In = Estroncio (Sr)
b) Se y Sb = Selenio (Se)
c) K y Br = Potasio (K)
d) N y Bi = Bismuto (Bi)
2. Radio atómico
3. Energía de ionización.
1. Organice en orden ascendente las siguientes series de elementos, teniendo en cuenta su energía de ionización.
a) Pb, Sn, Si, C = Pb, Sn, Si, C
b) Sr, Sn, n, Rb = Rb, Sr, Sn, N
c) Cu, Au, Ag = Au, Ag, Cu
d) F, Sn, Ba, As = Ba, Sn, As, F
2. Explique por qué la energía de ionización aumenta de abajo hacia arriba en los grupos.
Por que necesita mayor energía para que se desprender su electrón ya que están más cerca del núcleo
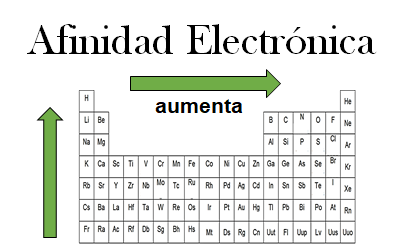
4. afinidad electrónica en los grupos y los periodos.
1. Organice en orden descendente los siguientes elementos de acuerdo a su afinidad electrónica.
a) P, As , y Sb = P, As, Sb
b) K, Ca, y Sc = Sc, Ca, K
c) F, Ga y P = F, P, Ga
d) Nb, Na y Au = Au, Nb, Na
2. Explique por qué la afinidad electrónica aumenta de izquierda a derecha en los periodos.
Cuando los electrones están cerca al núcleo, más energía es liberada cuando el átomo captura un electrón
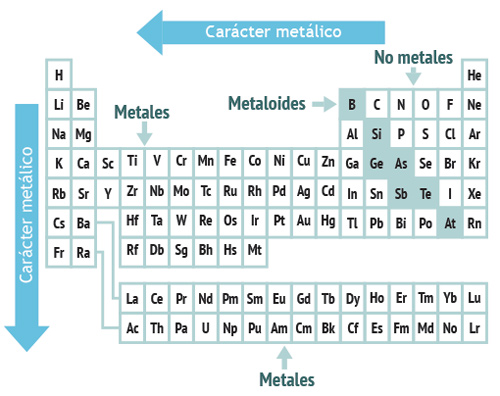
5. Carácter metálico
1. Ordene los siguientes elementos en orden ascendente de acuerdo a su carácter metálico:
a) F, I, Br, y Cl = F, Cl, Br, I
b) Nb, Ba, Fr, y Mn = Mn, Nb, Ba, Fr
c) B, C, N y O = O, N, C, B
d) Cd, Pd, In, y Ag = In, Cd, Ag, Pd
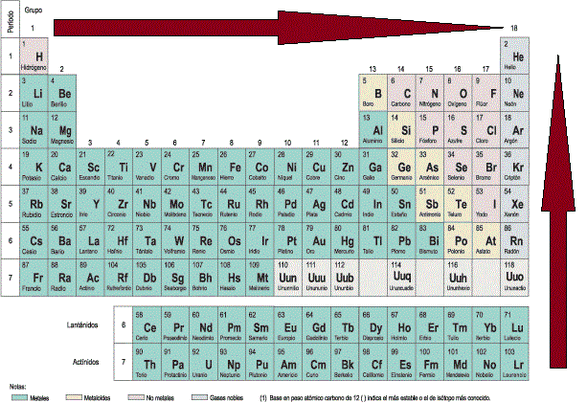
Figura 2. Propiedades periódicas de los elementos químicos
Responda las siguientes preguntas, teniendo en cuenta las propiedades periódicas de los elementos químicos.
1. Según la información de la Figura, es verdadero afirmar que:
a) El elemento 1 tiene mayor radio atómico que el 3.
= Verdadero
b) El elemento 4 tiene menor radio atómico que el 3.
=Falso
c) El elemento 5 tiene igual radio atómico que el 3.
=Falso
d) El elemento 4 tiene mayor radio atómico que el 1.
=Falso
2. De acuerdo con la información de la Figura 2, es correcto afirmar que el elemento más electronegativo se encuentra en la posición:
a) 1.
b) 5.
c) 3.
d) 4.
3. Compare las propiedades periódicas de la Figura 2 entre los elementos 1 y 5. Complete la siguiente tabla escribiendo sí la relación es mayor o menor:
b) Compare las propiedades periódicas de la Figura 2 entre los elementos 3 y 4. Complete la tabla escribiendo si la relación es mayor o menor:
4. De acuerdo con la Gráfica 1 “Número atómico contra Radio atómico”, escriba cómo varía el radio atómico con los periodos en la Tabla Periódica.
Esta desde el metal alcalino (Li) hasta el gas noble (periodo) (He) el radio atómico disminuye. Por el contrario, la variación de un grupo, por ejemplo el de los gases nobles, el radio va aumentando.
Es decir entre más metal menor es su radio atómico y entre mayor gas noble más radio atómico
URL consultada: Propiedades periódicas
https://lh3.googleusercontent.com/proxy/xi0O61b7arQlL2ZcYU2Yirl95Qyu CLYcOa6GvJV9ZwNNeYw4LgVerfmVWrvWFSPILDwASrR593gGUPhuVjXrU GSDXxZi2YULcf_DYI1OPNsRfYTL
http://aprende.colombiaaprende.edu.co/sites/default/files/naspublic/plan_choco/cie_8_b1_s4_est.pdf


No hay comentarios.:
Publicar un comentario